Содержание примесей в очищенном кремнеземе может быть снижено до 1 0-8 -1 0-6 массовых процентов. Более подробную информацию о производстве гиперчистого кремния см. в разделе «Поликристаллический кремний».
Содержание
Чистый кремний был выделен в 1811 году французскими учеными Жозефом Луи Гей-Люссаком и Луи Жаком Тенаром.
В 1825 году шведский химик Йонс Якоб Берцелиус смешал металлический калий с фторидом кремния SiF4 для получения чистого элементарного кремния. Новый элемент был назван кремнием (от латинского слова silex — кремень). Русское название кремния было придумано в 1834 году русским химиком Германом Ивановичем Гессом. С греческого языка оно переводится как kremnos — «утес, гора».
Нахождение в природе
Согласно различным источникам, процентное содержание кремния в земной коре составляет 27,6-29,5 % от массы. Это делает кремний вторым по распространенности элементом в земной коре после кислорода. Его концентрация в морской воде составляет 3 мг/л 2 .
В природе кремний встречается чаще всего в виде кремниевой кислоты — соединения на основе кремнезема (IV) SiO2 (Основными минералами и горными породами, состоящими из кремнезема, являются песок (речной песок и кварцевый песок), кварц и кварциты, кремень и полевой шпат. Силикаты и алюмосиликаты — вторая по распространенности в природе группа соединений кремния.
Существуют единичные случаи обнаружения чистого диоксида кремния в его природной форме.
Получить
«Свободный кремний можно получить путем прокаливания белого песка, который является диоксидом кремния, с магнием:
Получается коричневый порошок аморфного кремния». 4
Технический кремний производится в промышленности путем восстановления расплавленного SiO2 с коксом при температуре около 1800°C в шахтной печи. Чистота кремния, полученного таким способом, может достигать 99,9% (основными примесями являются углерод и металлы).
Также может быть проведена дальнейшая доработка кремния.
- Очистку в лаборатории можно провести, сначала очистив магний Mg.2Si. Моносилановый газ SiH4. Моносилан очищают дистилляцией, абсорбцией и другими способами, а затем разлагают на кремний и водород при температуре около 1000 °C.
- Очистка кремния в промышленных масштабах осуществляется путем прямого хлорирования кремния. В результате этого процесса образуются соединения с составами SiCl4 и SiCl3H. Эти хлориды отделяются от примесей с помощью различных процессов (обычно дистилляции и восстановления) и, наконец, восстанавливаются чистым водородом при температуре от 900 до 1100 °C.
- В настоящее время разрабатываются более дешевые, чистые и эффективные промышленные процессы рафинирования кремния. 2010: процессы с использованием фтора (вместо хлора) для рафинирования кремния; процессы дистилляции диоксида кремния; процессы, основанные на вытравливании примесей, сосредоточенных во внутрикристаллических ободках.
Содержание примесей в очищенном кремнии может быть снижено до 1 0-8 -1 0-6 массовых процентов. Более подробную информацию о производстве гиперчистого кремния можно найти в статье Поликристаллический кремний.
Процесс производства чистого кремния был разработан Николаем Бекетовым.
В России технический кремний производится UC Rusal на заводах в Каменске-Уральском (Свердловская область) и Шелехове (Иркутская область); Nitol Solar производит полихлоридно-очищенный кремний на заводе в Усолье-Сибирском.
Содержание примесей влияет на свойства полупроводников. Проводимость примесей обычно выше, чем собственная проводимость, поэтому примеси, введенные в структуру материала, значительно изменяют проводимость. Центр примеси может быть:
Кремний
Кремний — неметаллический элемент группы IVa периодической таблицы согласно D. Менделеев. После кислорода это второй по распространенности элемент в земной коре.
В чистом виде он практически не встречается в природе. Чаще всего он встречается в виде диоксида кремния — SiO2 — в песке, песчанике, кварце и глине.

Силика (Кремниевая долина)
Район в Калифорнии (США), характеризующийся высокой плотностью высокотехнологичных компаний, занимающихся производством компьютеров и микропроцессоров.
Кремний является природным полупроводником и используется в качестве основного материала для производства микросхем. Кремний ближе, чем вы думаете: внутри устройства, которым вы пользуетесь 😉

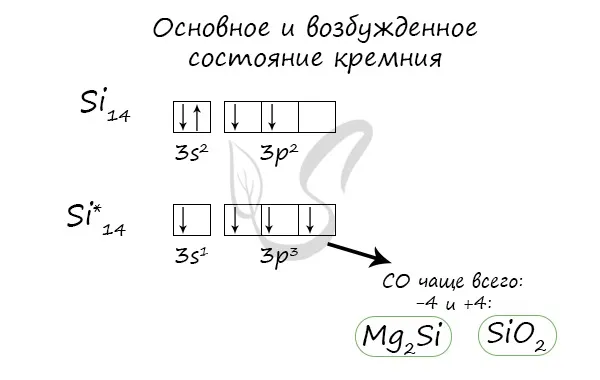
Основное и возбужденное состояния кремния
Когда атом кремния возбуждается, электроны в s-подложке испаряются, и один из них переходит в p-подложку.
Физические соединения
- SiO2 — Кварц, кремний, гранит, песчаник, песок, глина
- SiO2 с Fe 3+ — примесь цитрина
- SiO2 Fe 2+ и Fe 3+ — аметист

Получить
Кремний производится промышленным способом путем восстановления кремния в электрических печах с использованием тепла глинозема.
В лаборатории мелкий белый песок прокаливают с магнием:
SiO2 + Mg → (t) MgO + Si
Химические свойства
Кремний реагирует с фтором только при нормальных условиях без нагревания.
При нагревании кремний вступает в реакцию с другими галогенами (Cl, Br, I), углеродом и кислородом. При очень высоких температурах (1200 °C) кремний реагирует с кислородом, образуя оксид кремния II — оксид, не образующий солей.
Si + O2 → (t = 1200 °C) SiO

Диоксид кремния проявляет свое окислительное действие в аналогичных реакциях.
Ca + Si → Ca2Si (силицид кальция)
Для травления (удаления поверхностного слоя материала) кремниевые изделия могут быть погружены в раствор щелочи.
Оксид кремния IV — SiO2
Оксид кремния IV имеет атомную структуру и является очень твердым и прочным. Он плавится при температуре +1730 °C.
В промышленном процессе кремний нагревается в атмосфере кислорода для получения оксида IV.
Реакция силиката натрия с уксусной кислотой проводится в лаборатории. Кремнезем немедленно разлагается на SiO2который выпадает в осадок, и вода.

-
Реакции с кислотами
С химической точки зрения, SiO2 кислотоустойчив, но реагирует с газообразным фтористым водородом (газообразным) и плавиковой кислотой (жидкой).
SiO2 кислотный оксид, соответствующий кремниевой кислоте. Он реагирует с основными оксидами и щелочами и образует соли кислоты, так называемые силикаты.

Соединения кремния составляют основу стекла и цемента. В силикатной промышленности производятся стекло и цемент. Она также производит силикатную керамику, такую как кирпич, фарфор, фаянс и сопутствующую продукцию.
Свойства и характеристики

Поскольку кристаллический кремнезем является наиболее часто используемым материалом в промышленности, его свойства являются наиболее важными, и именно эти свойства приводятся в технических спецификациях. Физические свойства материала следующие:
- Температура плавления — 1417 C,
- температура кипения — 2600 C,
- Плотность составляет 2,33 г/см3, что означает, что он хрупкий,
- Как теплоемкость, так и теплопроводность не являются постоянными даже для самых чистых образцов: 800 Дж/(кг-К) или 0,191 кал/(град) и 84-126 Вт/(м-К) или 0,20-0,30 кал/(см-сек-градус).
- Пропускает длинноволновое инфракрасное излучение, используемое в инфракрасной оптике,
- Диэлектрическая проницаемость — 1,17,
- Твердость по Моосу — 7.
Электрические свойства неметалла в значительной степени зависят от примесей. В промышленности эта характеристика используется при разработке полупроводников нужного типа. Кремний хрупок при нормальной температуре, но может пластически деформироваться при нагревании выше 800°C.
Аморфный кремний имеет разительно другие свойства: он очень гигроскопичен и гораздо активнее реагирует даже при обычных температурах.
О структуре и химическом составе, а также о свойствах кремния рассказывается в следующем видеоролике:
Состав и структура
Кремний встречается в двух аллотропных формах, которые одинаково стабильны при нормальных температурах.
- Кристаллический вариант имеет вид темно-серого порошка. Хотя вещество имеет алмазоподобную кристаллическую решетку, оно хрупкое — из-за чрезвычайно больших связей между атомами. Интересны его полупроводниковые свойства.
- При очень высоком давлении можно получить гексагональную модификацию с плотностью 2,55 г/куб.см. Однако этот этап пока не нашел практического применения.
- Аморфный материал представляет собой коричневатый порошок. В отличие от кристаллической формы, он реагирует гораздо активнее. Это связано не столько с инертностью первой формы, сколько с тем, что материал покрывается слоем диоксида, находящегося в воздухе.
Кроме того, необходимо учитывать еще один тип классификации, который связан с размером кристаллов кремния, из которых состоит вещество. Общеизвестно, что кристаллическая решетка подразумевает не только расположение атомов, но и структуры, которые эти атомы образуют — так называемый дальний порядок. Чем выше порядок, тем более однородно вещество.
- Монокристаллический — образец является монокристаллическим. Его структура максимально упорядочена, а свойства однородны и легко предсказуемы. Это самый востребованный материал в электротехнике. Однако это и самый дорогой тип, поскольку процесс его приобретения сложен, а темпы роста низкие.
- Поликристаллический — образец состоит из множества крупных кристаллических зерен. Интерфейсы между ними образуют дополнительные слои несовершенств, которые снижают производительность образца как полупроводника и приводят к более быстрому износу. Технология выращивания поликристалла проще, а материал, соответственно, дешевле.
- Поликристаллический — состоит из большого количества зерен, расположенных хаотично по отношению друг к другу. Это самый чистый тип промышленного кремния, который используется в микроэлектронике и солнечной промышленности. Он часто используется в качестве сырья для производства поли- и монокристаллов.
- Аморфный кремний также занимает особое место в этой классификации. Здесь порядок атомов сохраняется только на самых коротких расстояниях. Однако он по-прежнему используется в электротехнике в виде тонких слоев.
Ниже приводится обзор сырья для производства кремния, рисков, связанных с добычей кремния, и технологий, используемых в мире и в России.
Производство неметалла
Чистый кремний не так легко извлечь, поскольку большинство соединений инертны и имеют высокую температуру плавления. Самый распространенный в отрасли метод — снижение углерода из двуокиси углерода. Реакция проводится в электродуговой печи при температуре 1800 °C. В результате реакции получается неметалл с чистотой 99,9%, что недостаточно для использования металла.
Материал хлорируется с получением хлоридов и гидрохлоридов. Затем соединения очищают от примесей всеми возможными методами и восстанавливают водородом.
Вещество также может быть очищено путем получения магниевого кремния. Силицид обрабатывается соляной или уксусной кислотой. Получается силан, который очищают различными методами — абсорбцией, дистилляцией и т.д. — используются для очистки силана. Затем силан разлагается при температуре 1000 С на водород и кремний. В этом случае получается вещество с содержанием примесей 1 0-8 -1 0-6 %.
Технический кремний производится в промышленности путем восстановления расплавленного SiO2 с коксом при температуре около 1800°C в шахтной печи. Чистота кремния, полученного таким способом, может достигать 99,9% (основными примесями являются углерод и металлы).
Сплавы, получение кремния
Кремний не может образовывать сплавы — это прерогатива металлов. Однако он способен растворять многие металлы. Эти соединения, называемые силицидами, используются в промышленности.
К ним относятся:
- Силумин,
- ферросилиций,
- Сплав PC 1004,
- Сплав PC 1714,
- Сплав PC 4800,
- сплав RS 5406.
Процесс производства кремния:
- В шахтных печах путем восстановления SiO2 из кокса (технически чистый кремний).
- Продукт далее очищается по реакции SiCl4+2H2 = Si+4HCl (восстановление тетрахлорида водорода при высокой температуре).
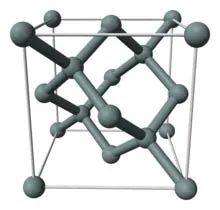
Высокочистый продукт (поликремний) для производства полупроводников и солнечных батарей подвергается дальнейшей очистке.
Плюсы и минусы
Кремний имеет множество преимуществ. К ним относятся:
- Доступность в добыче полезных ископаемых, простота получения продукта.
- Кремний нетоксичен и может использоваться в любой отрасли промышленности.
- Электро- и радиотехника не может обойтись без полупроводниковых свойств неметалла.
- Кремний может образовывать множество полезных и универсальных соединений.
Применение

Области применения кремния трудно перечислить:
- Стекло,
- цемент,
- прикуриватели,
- волоконная оптика,
- керамика,
- микропроцессоры.
Каждая зубная паста содержит E551, аморфный диоксид кремния.
Большинство наших домов на 20-40% состоят из кварца.
Нитрит и карбид кремния являются одними из самых твердых соединений. Они состоят из специальной термостойкой и твердой керамики. Они используются в производстве пуленепробиваемых жилетов и абразивных материалов (шлифовальные круги для известных абразивных дисков).
Кремний используется как сырье технической чистоты:
- В металлургии (в качестве добавок, как раскислитель при производстве чугуна и стали).
- В производстве силанов и кремнийорганических материалов.
- В производстве солнечных батарей.
Синтетический SiC под названием муассанит успешно заменяет алмазы в ювелирной промышленности.
Продукцией, изготовленной из песка, соды и известкового стекла, пользуются миллионы людей.
Красота и здоровье: полуметалл необходим человеческому организму для костей, волос и здоровой кожи. А силикон — это материал, который женщины используют для коррекции фигуры.
При нагревании кремний вступает в реакцию с другими галогенами (Cl, Br, I), углеродом и кислородом. При очень высоких температурах (1200 °C) кремний реагирует с кислородом, образуя оксид кремния II — оксид, не образующий солей.
Получить
Свободный кремний получают путем прокаливания мелкого белого песка (кварца) с магнием:
SiO2 + 2Mg ⟶ 2MgO + Si
В результате получается аморфный кремний в виде коричневого порошка.
Технический кремний производится в промышленности путем восстановления расплавленного SiO2 из кокса при температуре около 1800 °C в шахтных печах. Чистота продукта может достигать 99,9 % (основными примесями являются углерод и металлы).
Также может быть проведена дальнейшая доработка кремния.
- Очистку в лаборатории можно провести, сначала очистив магний Mg.2Si. Моносилановый газ SiH4. Моносилан очищают дистилляцией, абсорбцией и другими способами, а затем разлагают на кремний и водород при температуре около 1000 °C.
- Очистка кремния в промышленных масштабах осуществляется путем прямого хлорирования кремния. В результате этого процесса образуются соединения с составами SiCl4SiCl, SiHCl3 и SiH2Cl2. Они очищаются от примесей различными способами (обычно дистилляцией и диспропорционированием) и, наконец, восстанавливаются чистым водородом при температуре от 900 до 1100 °C.
- В настоящее время разрабатываются более дешевые, чистые и эффективные технологии промышленного рафинирования кремния. Некоторые из методов, разработанных в 2010 году, следующие: Очистка кремния с использованием фтора (вместо хлора); дистилляция монооксида кремния; технология, основанная на вытравливании примесей, сосредоточенных в межкристаллических гранях.
Содержание примесей в очищенном кремнеземе может быть снижено до 1 0-8 -1 0-6 массовых процентов. Более подробную информацию о производстве гиперчистого кремния см. в разделе «Поликристаллический кремний».
Процесс производства чистого кремния был разработан Николаем Бекетовым.
В России технический кремний производится UC Rusal на заводах в Каменске-Уральском (Свердловская область) и Шелехове (Иркутская область); Nitol Solar производит полихлоридно-очищенный кремний на заводе в Усолье-Сибирском.
Физические свойства
Кристаллическая решетка кремния кубическая и гранецентрированная, как у алмаза, с параметром α = 0,54307 нм (при высоком давлении были получены и другие полиморфные модификации кремния), но из-за большей длины атомной связи Si-Si по сравнению с длиной связи C-C твердость кремния значительно ниже, чем у алмаза. Кремний хрупок и становится вязким только при температуре выше 800 °C. Он проницаем для инфракрасного излучения. Он прозрачен для инфракрасного излучения с длиной волны 1,1 мкм. Собственная концентрация носителей заряда составляет 5,81⋅10 15 м-3 (при температуре 300 K).
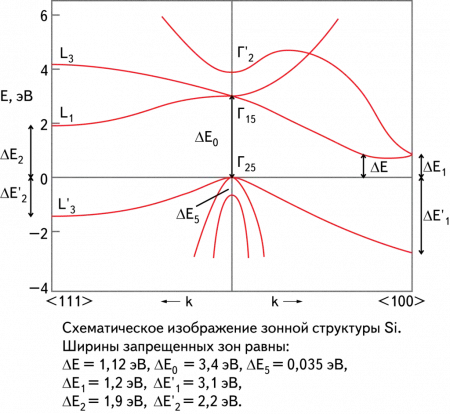
Электрофизические свойства
Элементарный кремний в монокристаллическом виде является полупроводником с непрямой щелью. Амплитуда полосовой щели составляет 1,12 эВ при комнатной температуре и 1,21 эВ при T = 0 K. Концентрация физических носителей заряда в кремнии при нормальных условиях составляет около 1,5⋅10 10 с м-3 .
Электрические свойства кристаллического кремния сильно зависят от содержащихся в нем примесей. Чтобы получить кристаллы кремния с дырочной проводимостью, в кремний вводят атомы элементов III группы, таких как бор, алюминий, галлий и индий. Чтобы получить кристаллы кремния с электронной проводимостью, в кремний вводят атомы элементов V группы, таких как фосфор, мышьяк и сурьма.
Электронные устройства на основе кремния в основном изготавливаются из поверхностного слоя монокристалла (толщиной до нескольких десятков мкм). Поэтому качество поверхности кристалла может оказывать значительное влияние на электрофизические свойства кремния и, следовательно, на свойства разрабатываемого электронного устройства. Некоторые устройства изготавливаются с помощью методов, изменяющих поверхность монокристалла, таких как обработка поверхности кремния различными химическими веществами и облучение.
- Диэлектрическая постоянная: 12
- Подвижность электронов: 1200-1450 см²/(В-с).
- Подвижность отверстий: 500 см²/(В-с).
- Ширина полосовой щели: 1,21 эВ при 0 К.
- Время жизни свободных электронов: 5 нс — 10 мс.
- Длина пути свободных электронов: порядка 1 мм.
- Длина свободного отверстия: около 0,2-0,6 мм.
Все значения приведены для нормальных условий.
Химические свойства
Гибридизация
Как и атомы углерода, атомы кремния также характеризуются состоянием гибридизации орбиталей sp 3. Благодаря этой гибридизации чистый кристаллический кремний образует алмазную решетку, в которой кремний является четырехвалентным. В соединениях кремний обычно ведет себя как четырехвалентный элемент со степенью окисления +4 ил и-4. Существуют некоторые двухвалентные соединения кремния, например, оксид кремния(II) — SiO.
Малая активность кремния
При нормальных условиях кремний химически неактивен и активно реагирует только с газообразным фтором, образуя летучий тетрафторид кремния SiF4.
Такая «инертность» кремния обусловлена пассивацией поверхности наноразмерным слоем диоксида кремния, который мгновенно образуется в присутствии кислорода, воздуха или воды (водяного пара).
Реакция с галогенами
Кремний реагирует с хлором, бромом и йодом — при нагревании выше 400-500 °C — с образованием соответствующих высоколетучих тетрагалогенидов SiHal4 и, возможно, более сложные галогениды.
Реакция с кислородом
При нагревании до температуры выше 400-500 °C кремний вступает в реакцию с кислородом, образуя SiO2.
Процесс сопровождается увеличением толщины слоя диоксида на поверхности; скорость окисления ограничивается диффузией атомарного кислорода через слой диоксида.
Получение монооксида кремния
Восстановление SiO2 из кремния при температуре выше 1200 °C образуется оксид кремния(II) — SiO.
Si + SiO2 → t>1200oC 2SiO
Этот процесс часто используется при производстве кристаллов кремния в соответствии с процессом кристаллизации Чохральского, поскольку кремниевые сосуды используются как наименее экологически вредный материал для кремния.
Получение силанов
Кремний не вступает в прямую реакцию с водородом. Соединения кремния с водородом — силаны общего вида SinH2 n+2 — производятся косвенно. Моносилан SiH4 (часто называемый просто силаном) выделяется, например, при взаимодействии силицидов металлов с растворами кислот:
SiH силан4 содержит примесь других силанов, особенно дисилана Si2H6 и трисилан Si3H8 которые имеют цепочку атомов кремния, соединенных одинарными связями (-Si-Si-Si-Si-Si-Si-Si-Si-Si- ).
Реакция с азотом и бором
Кремний реагирует с азотом и бором при температуре около 1000 °C с образованием Si3N4 и термически и химически стабильные бориды SiB3SiB, SiB6 и SiB12.
Получение карборунда
При температуре около 1000 °C из кремния и его углеродного аналога по таблице Менделеева может образоваться SiC (карборунд), который характеризуется высокой твердостью и низкой реакционной способностью.
Si + C → t>1000oC SiC
Карборунд часто используется в качестве абразива. Интересно, что расплавленный кремний (1415 °C) в виде больших кусков плотно упакованного мелкозернистого графита может находиться в контакте с углеродом в изостатическом прессе в течение длительного времени, не растворяясь и не взаимодействуя с последним.
Кремний растворяет многие металлы
Элементы четвертой группы (Ge, Sn, Pb) так же растворимы в кремнии, как и большинство других металлов.
Красота и здоровье: полуметалл необходим человеческому организму для костей, волос и здоровой кожи. А силикон — это материал, который женщины используют для коррекции фигуры.
Группы полупроводников
Все полупроводники делятся на три группы: полупроводники с атомной, валентной связью и полупроводники с ионной кристаллической решеткой.
Атомные полупроводники имеют атомную кристаллическую решетку. К ним относятся кремний, бор, сера, фосфор и селен.
В полупроводниках с ионной кристаллической решеткой атомы связаны кулоновскими силами, например, в сульфиде свинца.
В полупроводниках с валентными связями атомы образуют кристаллы в форме большой молекулы. Например, антимоноид индия, арсенид галлия.
Различают органические и неорганические полупроводники. Неорганические полупроводники имеют резонансную структуру, в их структуре нет молекул. Органические вещества состоят из атомов водорода и углерода и иногда гетероатомов (сера, кислород и азот).
Полупроводники также делятся на магнитные и немагнитные. Благодаря их свойствам, можно изменять проводимость материалов, воздействуя на них магнитными силами (полем). Магнитные полупроводники являются ферромагнетиками с собственной магнитной подрешеткой, а немагнитные полупроводники представляют собой диамагнитные кристаллические решетки. К немагнитным элементам относятся элементы, химические соединения и твердые растворы.
Практическое применение полупроводников
Полупроводники широко используются в промышленности и в аналоговой и цифровой электронике. В частности, они используются в электронике для изготовления транзисторов, интегральных схем, тиристоров, симисторов, лазеров, датчиков давления и диодов. Они также играют роль аксессуаров для оптических датчиков и систем передачи энергии. Полупроводники подходят для технологических разработок в области телекоммуникаций, управления и обработки сигналов в частном и промышленном применении.

Кремний активно используется для производства солнечных батарей и фотодиодов благодаря своим оптическим свойствам, но он не может быть источником света.
При производстве холодильников и кондиционеров полупроводники используются в системах охлаждения для контроля и поддержания температуры. В микроволновых печах есть полупроводник, необходимый для выработки тепла.
Различные полупроводники используются в зарядных устройствах для телефонов и ноутбуков для преобразования бытовой электроэнергии в постоянный ток.
Широкий спектр полупроводников используется для электронной связи.
Современная космическая техника не может обойтись без полупроводников. Они отвечают за запуск двигателей и поддержание скорости.
Полупроводники используются в технике для создания устройств для управления, позиционирования, определения направления и контроля скорости.
Современные процессоры содержат миллионы полупроводников, которые могут обрабатывать и быстро выполнять большие объемы данных. Поэтому компьютерные системы являются одной из основных областей, где внедряется этот тип оборудования.
Производство полупроводников
С середины двадцатого века полупроводниковая промышленность переживает бурный рост. Несмотря на постоянные кризисы, сегодня она быстро растет. Среди крупнейших мировых производителей — Южная Корея, Тайвань, Сингапур, Япония, Швейцария и США.

Процесс производства полупроводников состоит из пяти этапов. На первом этапе обрабатываются в основном кремниевые пластины. Затем пластины очищаются мокрым или газовым травлением и создается полупроводниковый слой, чтобы полупроводниковый материал мог продемонстрировать свои возможности. На следующем этапе топография на пластине подвергается фотолитографии и удаляются загрязнения. Затем на пластине формируются контакты и пассивные элементы. Изделия изготавливаются из лучшего металла методом вакуумного напыления.
Из-за сложности и дороговизны производства ни одна страна не производит полупроводники от начала до конца. Производственный процесс распределен по заводам в разных странах. Производство станков, комплектующих и программного обеспечения находится в разных странах.
Сейчас производители сосредоточены на ультратонких полупроводниках. Уменьшение нанометра означает увеличение стоимости, но скорость не меняется.