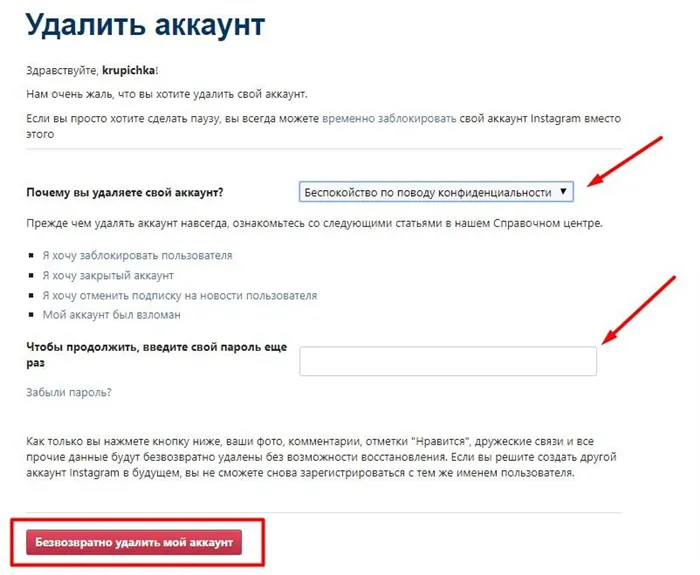
Неизвестно, узнали ли философы того времени об атомах от инопланетян или открыли их сами, но химики смогли подтвердить эту теорию экспериментально лишь много позже — только в семнадцатом веке, когда Европа оставила позади бездны инквизиции и Средневековья.
Электроны: на задворках атомов
Электроны, крошечные объекты, живущие на обратной стороне атомов, играют ключевую роль в химии, проводят электричество в наших электросетях и через молнии, а также являются «катодными лучами», используемыми для создания изображений на экранах телевизоров и компьютеров двадцатого века. Это наиболее типичный пример (кажущихся) элементарных частиц.
Под «элементарным» я подразумеваю, что электроны неделимы и не состоят из более мелких частиц. Говоря «по-видимому», я напоминаю, что они элементарны настолько, насколько позволяет судить нынешний уровень знаний — то, что мы знаем об электронах, получено в результате экспериментов, а наши эксперименты не обладают бесконечной силой. Если электроны не элементарны, но настолько малы, что их невозможно проанализировать с помощью наших нынешних экспериментов, они будут казаться элементарными во всех экспериментах, которые мы проводили в прошлом и настоящем, но не во всех будущих экспериментах. Поэтому однажды — поскольку 80 лет назад люди думали, что протоны могут быть элементарными, но они не знали, а 150 лет назад люди думали, что атомы могут быть элементарными, но они не знали — мы можем узнать, что электроны не элементарны. Но поскольку все доступные нам эксперименты показывают, что они элементарны, мы будем условно считать, что это так — помните, что это отчасти экспериментальный факт, а отчасти гипотеза! Электрон был первой открытой субатомной частицей (первый объект размером меньше атома). Во время его открытия в 1890-х годах (обычно пишут 1897 год, но открытие было постепенным), научные дебаты о том, состоит ли материя из атомов или атомы являются лишь плодом воображения, используемым для описания поведения материи, подходили к концу. Но даже те, кто верил в существование атомов, не обязательно считали, что атомы неделимы (как следует из их названия, происходящего от греческого «akompsos»). Через поколение, в середине 1930-х годов, физики подтвердили существование атомов, поняли их основную структуру и научились с большой точностью рассчитывать их свойства. Они выполнили эти расчеты, используя уравнения из теории поведения материи 1920-х годов, известной как «квантовая механика», которая стала необходимой, поскольку знаменитые уравнения Ньютона не могли описать, как работают атомы. Многие основные тесты для проверки точности квантовой механики включали в себя точные измерения поведения электронов внутри и снаружи атомов.
Все электроны одинаковы и неразличимы; если поменять местами два из них, то ничего не будет видно. Поэтому я могу написать о «свойствах электрона», и вы можете быть уверены, что эти свойства одинаковы для всех электронов. Каковы же их свойства?
Масса!
Электрон имеет массу — она мала по сравнению с массой любого атома, поэтому о ней можно в основном забыть на уроках химии в начальной школе, но она не настолько мала, чтобы о ней забыли в физике частиц, даже при понимании структуры атомов. Хотя электроны не вносят большого вклада в массу атома, масса электронов необходима для определения размера атома. Это особенно верно в отношении важности поля и частицы Хиггса. Эта масса может быть записана различными способами, и каждый метод предлагает свой взгляд:
- Это соответствует примерно 9 × 1 0-31 кг = 0,000 000 000 000 000 000 000 000 000 000 000 000 000 000 000 000 000 000 000 9 кг.
- Это соответствует примерно 0,05 % (ровно 1/1838) массы атома водорода, самого легкого атома в природе. Большая часть его массы содержится в ядре.
- Энергия, запасенная в массе электрона, E = mc 2, равна 0,000 511 ГэВ. Это соответствует энергии одного зеленого фотона в 200 000 раз больше. В физике частиц масса частицы часто задается в терминах обратной зависимости между энергией и массой: для неподвижной частицы m = E / c 2. В этом смысле масса электрона составляет 0,000511 ГэВ / c 2 .
Электрический заряд!
Электрон имеет электрический заряд — поэтому на него воздействуют электрические и магнитные поля. На электрически заряженную частицу, находящуюся в электрическом поле, действует электрическая сила. Именно эта сила удерживает электроны внутри атомов.
Каков электрический заряд электрона? Представьте себе статическое электричество — вы проводите ботинками по ковру, а затем, когда вы касаетесь дверной ручки, другого человека или компьютера (. ), вы чувствуете искру. Эта искра переносит заряд из одного места в другое — и он обычно в 10 миллионов раз больше, чем заряд электрона. Физики измеряют заряд в произвольной единице, называемой кулоном (так же, как время измеряется в секундах, а длина — в метрах). Типичный статический заряд содержит одну миллионную долю килограмма. Величина заряда электрона обычно обозначается e, и e приблизительно равно 1,6 × 1 0-19 Кл.
Атом (греч. a — отрицательная частица + tomos — деление, греч. atmos — неразделенный) — электрически нейтральная частица материи микроскопического размера и массы, состоящая из положительно заряженного ядра (протонов) и отрицательно заряженных электронов (электронных орбиталей).
Атом может иметь электрический заряд
Электроны несут отрицательный заряд, протоны — положительный, а нейтроны не имеют электрического заряда. Атом является электрически нейтральным, если он имеет одинаковое количество электронов и протонов.
Однако если атом имеет меньше или больше протонов, чем электронов, он имеет общий положительный или отрицательный заряд (его называют ионом).
94 Атома естественного происхождения на Земле
Из 118 известных атомов 94 встречаются в природе, хотя и в небольших количествах. Остальные 24 были синтезированы только в лабораториях или ядерных реакторах.
Каждый атом содержит определенное количество протонов в своем ядре. Например, все атомы натрия содержат 11 протонов, а все атомы серебра — 47 протонов.
Изотоп элемента определяется числом нейтронов, а магнитные свойства зависят от числа электронов в атоме.
Самый большой и самый маленький атом
Самым крупным элементом (по размеру) является францвестий, но поскольку он крайне нестабилен, предпочтение отдается цезию. Он имеет большую валентную оболочку и относительно низкий эффективный ядерный заряд.
Самый маленький элемент — гелий, первый в группе благородных газов в периодической таблице. Его атомный радиус примерно в 9 раз меньше, чем у цезия.

Иллюстрация атома гелия | Предоставлено Wikimedia.
Число энергетических уровней в атоме равно числу периодов, в которых находится химический элемент. Энергетические уровни обычно обозначаются следующим образом (рис. 7).
Атомы и электроны
Сейчас мы входим в мир химии, мир молекул и атомов. В этой статье мы обсудим основные понятия и рассмотрим электронные типы элементов.
Атом (греч. a — отрицательная частица + tomos — деление, греч. atmos — неразделенный) — электрически нейтральная частица материи микроскопического размера и массы, состоящая из положительно заряженного ядра (протонов) и отрицательно заряженных электронов (электронных орбиталей).
Описанная модель атома называется «планетарной моделью» и была предложена в 1913 году великими физиками Нильсом Бором и Эрнестом Резерфордом.
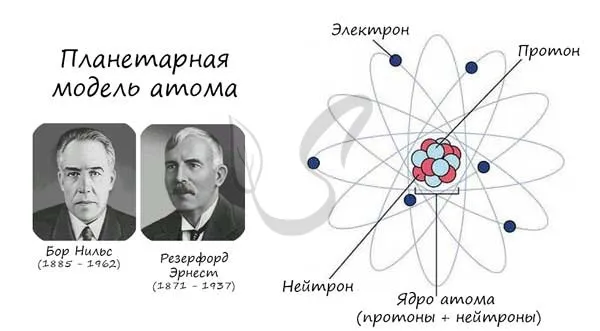
Протон (греч. proton — первый) — положительно заряженная (+1) элементарная частица, которая вместе с нейтронами образует атомные ядра элементов. Нейтрон (лат. neutral — ни тот, ни другой) — нейтральная (0) элементарная частица, которая встречается в ядрах всех химических элементов, кроме водорода.
Электрон (греч. electron — янтарь) — стабильная элементарная частица с отрицательным электрическим зарядом (-1), заряд атома — порядковый номер в матрице Менделеева — соответствует количеству электронов (и, соответственно, протонов).
Помните, что атом в невозбужденном состоянии содержит одинаковое количество электронов и протонов. Таким образом, кальций (число порядка 20) имеет 20 протонов в ядре и 20 электронов вокруг ядра на электронных орбиталях.

Я хотел бы еще раз подчеркнуть эту важную деталь. В этот момент очень хорошо было бы запомнить простое правило: номер класса элемента = количеству электронов. Это очень важно для практического применения и для изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в постоянном движении вокруг ядра атома. Энергия электронов различна, поэтому электроны занимают разные энергетические уровни.
Он состоит из s подуровней: ячейка «1s», в которой находится 2 электрона (заполненная электронами — 1s 2 ).
Он состоит из s-подуровня: одной s-элемента (2s 2 ) и p-подуровня: трех p-элементов (2p 6 ), содержащих 6 электронов.
Он состоит из s-уровня: одна s-ячейка (3s 2 ), p-уровня: три p-ячейки (3p 6 ) и d-уровня: пять d-ячеек (3d 10 ), содержащих 10 электронов.
Он состоит из s-уровня: одна ячейка «s» (4s 2 ), p-уровня: три ячейки «p» (4p 6 ), d-уровня: пять ячеек «d» (4d 10 ) и f-уровня: семь ячеек «f» (4f 14 ) с 14 электронами.
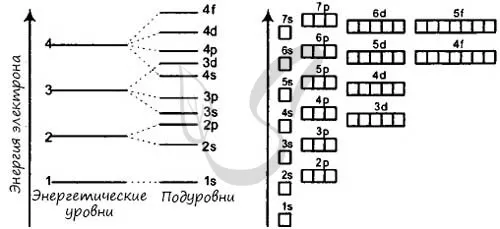
Зная теорию энергетических уровней и порядковый номер элемента из матрицы Менделеева, вы должны разместить определенное количество электронов, начиная с самого низкого энергетического уровня и поднимаясь к самому высокому. Далее вы увидите несколько примеров и узнаете об исключении, которое только подтверждает заданные правила.
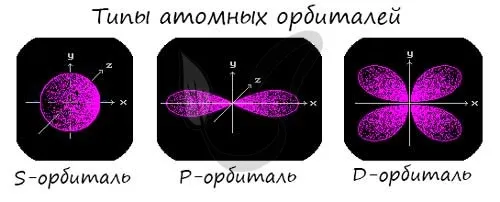
Подуровни «s», «p» и «d», о которых мы только что говорили, имеют определенную конфигурацию в пространстве. Электроны перемещаются по этим подуровням или атомным орбиталям и образуют определенный «узор».
Ядро S выглядит как сфера, ядро p — как песочные часы, а ядро d — как клеверный лист.
Правила заполнения электронных орбиталей и примеры
- Сначала заполните орбитали с наименьшей энергией и только потом переходите к орбиталям с наибольшей энергией.
- На одной орбитали (в «клетке») может находиться не более двух электронов.
- Орбитали заполняются электронами следующим образом: Сначала в каждую ячейку помещается один электрон, затем орбитали заполняются другим электроном в противоположном направлении.
- Порядок заполнения орбиталей: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s